河南商報訊(記者 郭丁然) 4月27日,河南商報記者從鄭州市科技局了解到,,鄭州安圖生物工程股份有限公司新型冠狀病毒抗體檢測試劑盒(膠體金法)獲美國食品藥品監(jiān)督管理局(FDA)緊急使用授權(quán)(EUA, Emergency Use Authorization)。

這是國內(nèi)首個獲得該授權(quán)的新冠病毒抗體檢測產(chǎn)品,。本次獲批的新型冠狀病毒抗體檢測試劑盒(膠體金法)一卡雙測,,同時滿足IgG、IgM抗體的快速檢測需求,。
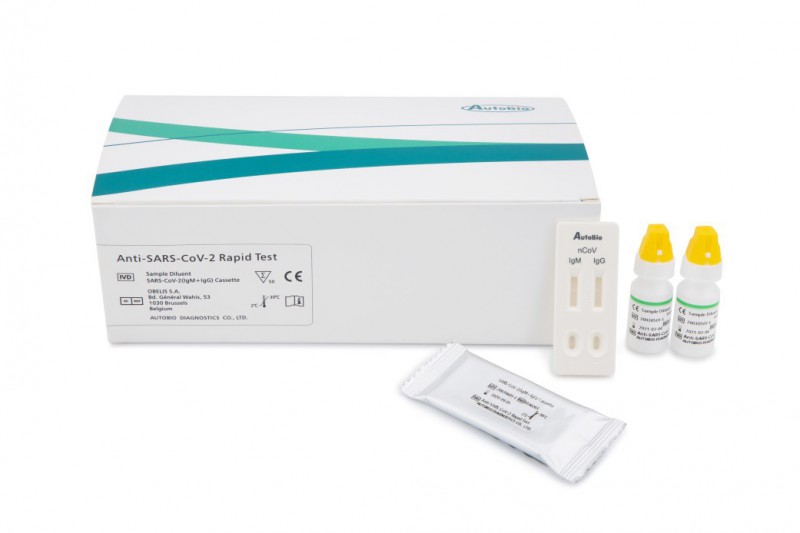
值得注意的是,,本次獲批的是新型冠狀病毒抗體檢測試劑盒,,與核酸檢測試劑盒的工作原理有所不同,。
河南商報記者了解到,核酸檢測的是病毒RNA(核糖核酸),,是病毒存在的直接證據(jù),;抗體檢測是檢測患者血液中被刺激產(chǎn)生的抗體,是間接證據(jù),。間接證據(jù)可以對臨床有所提示,,但仍需直接證據(jù)進(jìn)行確診。
抗體檢測的優(yōu)勢是速度快,、簡便、判讀方便,、可作現(xiàn)場即時檢測(POCT),。因此,抗體檢測作為核酸檢測的一種有效補充,,其檢測結(jié)果具有流行病學(xué)意義,,是認(rèn)識新冠感染發(fā)生、發(fā)展,、預(yù)后,、轉(zhuǎn)歸的重要手段。
國家藥監(jiān)局器械監(jiān)管司副司長張琪在4月5日的國務(wù)院聯(lián)防聯(lián)控機制新聞發(fā)布會上曾說過:“目前我國抗體檢測試劑僅用作對新冠病毒核酸檢測陰性疑似病例的補充檢測,,或在疑似病例診斷中與核酸檢測協(xié)同使用,,不作為新冠病毒感染者確診和排除的依據(jù),,也不適用于一般人群的篩查??贵w檢測試劑僅限醫(yī)療機構(gòu)使用,。”
據(jù)介紹,新型冠狀病毒(2019-nCoV)抗體檢測試劑盒(膠體金法)是安圖生物承擔(dān)的鄭州市新型冠狀病毒防控應(yīng)急科研攻關(guān)項目“新型冠狀病毒(2019-nCoV)快速檢測試紙條的研制”研究成果,。自今年2月初新型冠狀病毒防控應(yīng)急科研攻關(guān)項目啟動以來,,安圖生物科研團(tuán)隊經(jīng)過不懈努力,順利完成了該抗體檢測試紙條開發(fā),,取得了很好的成效,。初步臨床結(jié)果顯示,在發(fā)病 7 天以上的病人中,,總陽性率可達(dá) 80%-95%,。
目前該產(chǎn)品在國外上市銷售的同時,國內(nèi)注冊也在同步進(jìn)行中,。
當(dāng)前,,全球新冠肺炎疫情持續(xù)蔓延,形勢嚴(yán)峻,。此次新冠病毒抗體檢測試劑盒(膠體金法)獲美國FDA緊急使用授權(quán),,將為全球疫情防控做出積極貢獻(xiàn)。
統(tǒng)籌:趙強
編輯:楊桂芳

